Larutan elektrolit dapat menghantarkan arus listrik karena.
Jika kamu mencari artikel larutan elektrolit dapat menghantarkan arus listrik karena terlengkap, berarti kamu telah berada di web yang tepat. Yuk langsung aja kita simak ulasan larutan elektrolit dapat menghantarkan arus listrik karena berikut ini.
 Ha1 Ha Di Bawah Ini Tent Descubre Como Resolverlo En Qanda From qanda.ai
Ha1 Ha Di Bawah Ini Tent Descubre Como Resolverlo En Qanda From qanda.ai
Larutan elektrolit dapat menghantarkan arus listrik karena dalam larutannya mengandung. Hantaran listrik dapat terjadi karena adanya ion positif dan ion negatif yang bergerak. Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik. Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas.
Salah satu syarat sebuah larutan termasuk ke dalam larutan elektrolit atau dapat menghantarkan listrik adalah larutan tersebut dapat mengalami ionisasi.
Ion-ion inilah yang nantinya akan menjadi penghantar. Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Hal ini terjadi karenaA NaCl membuat - Brainlycoid TERJEMAHAN PRESENTASI KIMIA - DOCX Document 40 Soal Larutan Elektrolit Dan Non Elektrolit Serta Pembahasannya Larutan Elektrolit dan Non Elektrolit Rumus Soal Perbedaan Larutan Elektrolit dan Non Elektrolit Pengertian Contoh. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Jawaban benar.
 Source: arispratiwi81.blogspot.com
Source: arispratiwi81.blogspot.com
Berdasarkan daya hantarnya larutan elektrolit dibagi menjadi dua yaitularutan elektrolit kuat dimana daya hantarnya besarcontohnya adalah larutan NaCl atau lebih sering disebut laurtan garam. Zat terlarut dengan konsentrasi tinggi. Larutan elektrolit ini berkaitan dengan konsep asam basa. Larutan non-elektrolit merupakan larutan yang tidak bisa menghantarkan arus listrik. Larutan elektrolit dan non elektrolit.
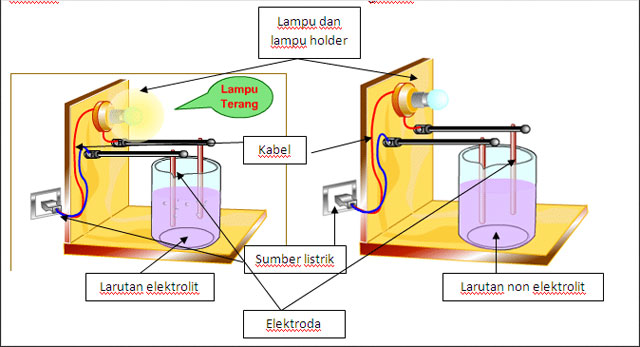
Larutan elektrolit merupakan larutan yang dapat menghantarkan arus listrik.
Larutan Kcl Merupakan Larutan Elektrolit Dapat Menghantarkan Arus Listrik Karena. Selain dari ikatannya terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik. Larutan elektrolit merupakan larutan yang dapat menghantarkan arus listrik. Larutan elektrolit dapat menghantarkan arus listrik karena dalam larutannya mengandung.
 Source: sites.google.com
Source: sites.google.com
Larutan NaCl ternyata dapat menghantarkan arulistrik. Larutan Kcl Merupakan Larutan Elektrolit Dapat Menghantarkan Arus Listrik Karena. Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Larutan elektrolit dan non elektrolit.
 Source: arispratiwi81.blogspot.com
Source: arispratiwi81.blogspot.com
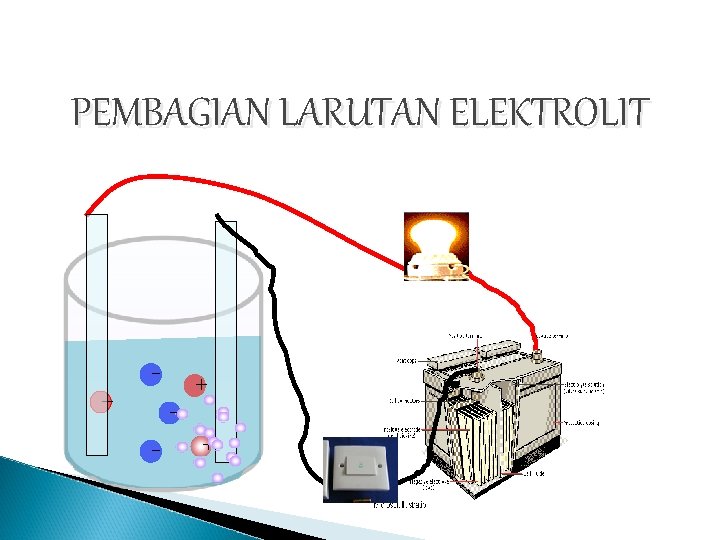
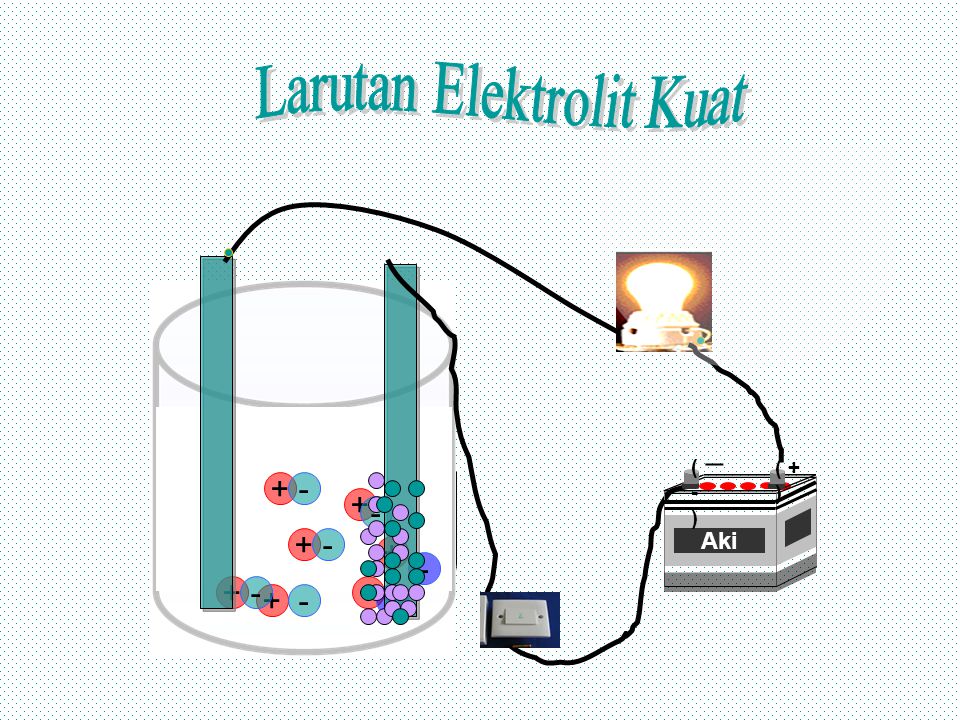
Ion-ion yang dapat bergerak bebas. Zat terlarut dengan konsentrasi tinggi. Pada larutan elektrolit yang dilengkapi dengan elektroda dan rangkaian listrik ion-ion negatif bergerak menuju elektroda yang bermuatan positif dan melepaskan elektron kemudian ion-ion. Ion-ion inilah yang nantinya akan menjadi penghantar.
 Source: slidetodoc.com
Source: slidetodoc.com
Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Dalam teorinya tentang ionisasi Arrhenius menyebutkan bahwa larutan elektrolit dapat menjadi penghantar listrik karena didalamnya mengandung atom atau kumpulan atom bermuatan listrik. Hal ini terjadi karenaA NaCl membuat - Brainlycoid TERJEMAHAN PRESENTASI KIMIA - DOCX Document 40 Soal Larutan Elektrolit Dan Non Elektrolit Serta Pembahasannya Larutan Elektrolit dan Non Elektrolit Rumus Soal Perbedaan Larutan Elektrolit dan Non Elektrolit Pengertian Contoh. Larutan Kcl Merupakan Larutan Elektrolit Dapat Menghantarkan Arus Listrik Karena.
Demikianlah pembahasan singkat mengenai alasan mengapa larutan elektrolit dapat menghantarkan listrik sementara larutan nonelektrolit tidak. Dalam larutan zat not-elektrolit tetap seperti molekul yang tidak bermuatan listrik. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Salah satu syarat sebuah larutan termasuk ke dalam larutan elektrolit atau dapat menghantarkan listrik adalah larutan tersebut dapat mengalami ionisasi.
Selain dari ikatannya terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik.
Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Ion-ion inilah yang nantinya akan menjadi penghantar. Selang Ais Vixion Mu Vs Burnley Theo James And Shailene Woodley Ayo Menabung Saham Bibit Ayam Potong Pekanbaru. Berdasarkan daya hantarnya larutan elektrolit dibagi menjadi dua yaitularutan elektrolit kuat dimana daya hantarnya besarcontohnya adalah larutan NaCl atau lebih sering disebut laurtan garam. Ion tersebutlah yang menghantarkan listrik melalui larutan.
 Source: zahratunnufus.wordpress.com
Source: zahratunnufus.wordpress.com
Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit dapat menghantarkanarus listrik sedangkan larutan non elektrolit tidak menghantarkan arus. Demikianlah pembahasan singkat mengenai alasan mengapa larutan elektrolit dapat menghantarkan listrik sementara larutan nonelektrolit tidak. Larutan elektrolit dan non elektrolit. Salah satu penyebab larutan NH4OH dapat menghantarkan arus listrik karena larutan ini dapat terionisasi sebagain di dalam larutan.
Ion-ion yang dapat bergerak bebas. Selang Ais Vixion Mu Vs Burnley Theo James And Shailene Woodley Ayo Menabung Saham Bibit Ayam Potong Pekanbaru. Menghantarkan arus listrik disebut larutan elektrolit dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan non elektrolit. Selain dari ikatannya terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik.
Salah satu syarat sebuah larutan termasuk ke dalam larutan elektrolit atau dapat menghantarkan listrik adalah larutan tersebut dapat mengalami ionisasi.
Ion tersebutlah yang menghantarkan listrik melalui larutan. Semakin banyak ion yang dihasilkan maka semakin kuat pula sifat daya hantar listrik larutan tersebut. Ion-ion inilah yang nantinya akan menjadi penghantar. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan arus listrik disebut larutan elektrolit dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit.
 Source: contoh123.info
Source: contoh123.info
Jawaban benar. Selain dari ikatannya terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik. Hantaran listrik dapat terjadi karena adanya ion positif dan ion negatif yang bergerak. Ion-ion yang dapat bergerak bebas.
 Source: kompas.com
Source: kompas.com
Terionisasi sebagian dalam larutan. Menurut Arrheniuslarutan elektrolit dapat menghantarkan listirk karena mengandung ion - ion yang dapat bergerak bebas. Semakin banyak ion yang dihasilkan maka semakin kuat pula sifat daya hantar listrik larutan tersebut. Ion - ion tersebutlah yang menghantarkan arus listrik melalui larutan.
 Source: iinlestariblog.wordpress.com
Source: iinlestariblog.wordpress.com
Hal ini terjadi karenaA NaCl membuat - Brainlycoid TERJEMAHAN PRESENTASI KIMIA - DOCX Document 40 Soal Larutan Elektrolit Dan Non Elektrolit Serta Pembahasannya Larutan Elektrolit dan Non Elektrolit Rumus Soal Perbedaan Larutan Elektrolit dan Non Elektrolit Pengertian Contoh. Larutan elektrolit merupakan larutan yang dapat menghantarkan arus listrik. Larutan non-elektrolit merupakan larutan yang tidak bisa menghantarkan arus listrik. Semakin banyak ion yang dihasilkan maka semakin kuat pula sifat daya hantar listrik larutan tersebut.
Semakin banyak ion yang dihasilkan maka semakin kuat pula sifat daya hantar listrik larutan tersebut.
Ion tersebutlah yang menghantarkan listrik melalui larutan. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan arus listrik disebut larutan elektrolit dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit. Larutan-larutan non-elektrolit terdiri atas zat-zat yang terlarut dalam air namun tidak terurai menjadi ion tidak terionisasi. Larutan elektrolit ini berkaitan dengan konsep asam basa. Salah satu penyebab larutan NH4OH dapat menghantarkan arus listrik karena larutan ini dapat terionisasi sebagain di dalam larutan.
 Source: slideshare.net
Source: slideshare.net
Ion-ion tersebut berperan menghantarkan arus listrik melalui larutan. Ion-ion yang dapat bergerak bebas. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Terionisasi sebagian dalam larutan. Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit.
Dalam larutan zat not-elektrolit tetap seperti molekul yang tidak bermuatan listrik.
Larutan Kcl Merupakan Larutan Elektrolit Dapat Menghantarkan Arus Listrik Karena. Dalam teorinya tentang ionisasi Arrhenius menyebutkan bahwa larutan elektrolit dapat menjadi penghantar listrik karena didalamnya mengandung atom atau kumpulan atom bermuatan listrik. Berdasarkan daya hantarnya larutan elektrolit dibagi menjadi dua yaitularutan elektrolit kuat dimana daya hantarnya besarcontohnya adalah larutan NaCl atau lebih sering disebut laurtan garam. Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas.
 Source: slideshare.net
Source: slideshare.net
Zat terlarut dengan konsentrasi tinggi. Ion tersebutlah yang menghantarkan listrik melalui larutan. Ion-ion inilah yang bertugas menghantarkan arus listrik seperti diperlihatkan pada Gambar 13. Ion-ion inilah yang nantinya akan menjadi penghantar.
 Source: slidetodoc.com
Source: slidetodoc.com
Larutan elektrolit ini berkaitan dengan konsep asam basa. Berdasarkan daya hantarnya larutan elektrolit dibagi menjadi dua yaitularutan elektrolit kuat dimana daya hantarnya besarcontohnya adalah larutan NaCl atau lebih sering disebut laurtan garam. Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik. Zat terlarut dengan konsentrasi tinggi.
 Source: slideshare.net
Source: slideshare.net
Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Larutan elektrolit merupakan larutan yang dapat menghantarkan arus listrik. Dalam teorinya tentang ionisasi Arrhenius menyebutkan bahwa larutan elektrolit dapat menjadi penghantar listrik karena didalamnya mengandung atom atau kumpulan atom bermuatan listrik. Salah satu syarat sebuah larutan termasuk ke dalam larutan elektrolit atau dapat menghantarkan listrik adalah larutan tersebut dapat mengalami ionisasi.
Zat terlarut dengan konsentrasi tinggi.
Ion-ion inilah yang nantinya akan menjadi penghantar. Zat terlarut dengan konsentrasi tinggi. Menghantarkan arus listrik disebut larutan elektrolit dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan non elektrolit. Selain dari ikatannya terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik. Pada larutan elektrolit yang dilengkapi dengan elektroda dan rangkaian listrik ion-ion negatif bergerak menuju elektroda yang bermuatan positif dan melepaskan elektron kemudian ion-ion.
 Source: iinlestariblog.wordpress.com
Source: iinlestariblog.wordpress.com
Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit. Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Zat terlarut dengan konsentrasi tinggi. Larutan elektrolit dan non elektrolit. Larutan non-elektrolit merupakan larutan yang tidak bisa menghantarkan arus listrik.
Selang Ais Vixion Mu Vs Burnley Theo James And Shailene Woodley Ayo Menabung Saham Bibit Ayam Potong Pekanbaru.
Ion tersebutlah yang menghantarkan listrik melalui larutan. Salah satu syarat sebuah larutan termasuk ke dalam larutan elektrolit atau dapat menghantarkan listrik adalah larutan tersebut dapat mengalami ionisasi. Terionisasi sebagian dalam larutan. Ion-ion itulah yang menghantarkan listrik lewat larutan.
 Source: pt.slideshare.net
Source: pt.slideshare.net
Menurut Svante August Arrhenius ilmuwan asal Swedia larutan elektrolit bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Ion-ion yang dapat bergerak bebas. Demikianlah pembahasan singkat mengenai alasan mengapa larutan elektrolit dapat menghantarkan listrik sementara larutan nonelektrolit tidak. Larutan elektrolit dapat menghantarkan listrik karena pada larutan elektrolit terdapat ion-ion yang dapat bergerak bebas. Larutan elektrolit dapat menghantarkanarus listrik sedangkan larutan non elektrolit tidak menghantarkan arus.
 Source: slideshare.net
Source: slideshare.net
Ion-ion inilah yang nantinya akan menjadi penghantar. Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik. Larutan Kcl Merupakan Larutan Elektrolit Dapat Menghantarkan Arus Listrik Karena. Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Suatu zat dapat menghantarkan listrik karena zat tersebut memiliki ion-ion yang bergerak bebas di dalam larutan tersebut.
 Source: slideplayer.info
Source: slideplayer.info
Zat terlarut dengan konsentrasi tinggi. Ion-ion yang dapat bergerak bebas. Salah satu syarat sebuah larutan termasuk ke dalam larutan elektrolit atau dapat menghantarkan listrik adalah larutan tersebut dapat mengalami ionisasi. Larutan elektrolit dan non elektrolit. Ion-ion itulah yang menghantarkan listrik lewat larutan.
Situs ini adalah komunitas terbuka bagi pengguna untuk menuangkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini bagus, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul larutan elektrolit dapat menghantarkan arus listrik karena dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.